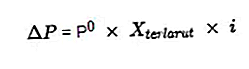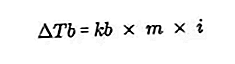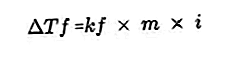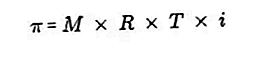Спробуйте звернути увагу на те, що навколо нас пов’язане з хімією? Найпростішим є повітря, яким ми дихаємо, що містить суміш кисню, азоту та інших газів. Харчові приправи, харчові барвники та консерванти - це також інші приклади хімічних речовин, які є навколо нас. Хімія - це розділ природознавства, який ви будете вивчати в школі, який вивчає різні матеріали, одним із прикладів є структура речовини, властивості речовини, форма матеріалу, зміни речовини, класифікація речовини, розташування речовини та енергії, що супроводжує їх зміни. Ви знаєте, не тільки математика та фізика, хімія також має різні види формул. Є багато хімічних формул, з яких ви дізнаєтесь, від колігативних властивостей до окисно-відновних реакцій.
З цієї нагоди ми вивчимо різні хімічні формули, а також приклади їх проблем, які допоможуть вам зрозуміти поняття хімічних формул.
Хімічні формули та приклади задач
Наявність формул у хімії має допомогти дослідникам знаходити різні види експериментальних результатів, які потрібно проводити. Щоб мати можливість добре оволодіти цією наукою, ви повинні знати деякі хімічні формули, з якими ви часто стикаєтесь під час вивчення хімії.
Формула колігативних властивостей розчинів
Колігативна природа розчину - це природа розчину, яка не залежить від типу розчинної речовини, а залежить лише від концентрації частинок розчину. Тоді колігативні властивості розчину складаються з двох типів властивостей, а саме колігативної природи розчину електроліту та колігативної природи неелектролітного розчину.
- Колігативні властивості неелектролітних розчинів
Хоча колігативна природа включає розчин, колігативна природа залежить не від взаємодії розчиненої речовини та молекул розчиненої речовини, а від кількості розчиненої в розчині розчиненої речовини. Колігативні властивості полягають у зниженні тиску пари, збільшенні температури кипіння, зниженні температури замерзання та осмотичному тиску. Для отримання кожного потрібна хімічна формула.
- Рівняння перепаду тиску пари

Джерело: formula.co.id
- Рівняння збільшення температури кипіння
Температура кипіння рідини - це фіксована температура, при якій вона закипає. При цій температурі тиск пари рідини має рівняння для тиску повітря навколо себе і зумовлене випаровуванням усіх частин рідини. Температуру кипіння рідини можна виміряти тиском в 1 атмосферу.
Різниця в температурі кипіння розчину і температурі кипіння чистого розчинника називається збільшенням температури кипіння, рівняння для збільшення температури кипіння має вигляд:

Джерело: formula.co.id
- Рівняння падіння точки замерзання
Розчинена речовина, присутня в розчині, зробить температуру замерзання розчину меншою, ніж точку замерзання розчинника. Рівняння зменшення точки замерзання:

Джерело: formula.co.id
- Осмотичний тиск
Осмотичний тиск - це сила, необхідна для врівноваження тиску розчинника від напівпроникної мембрани через розчин.
Напівпроникна мембрана - це мембрана, через яку можуть проходити молекули розчинника, але розчинені речовини не можуть пройти. За словами Вант-Гоффа, при осмотичному тиску розчин формулюється наступним чином:

Джерело: formula.co.id
- Колігативні властивості розчинів електролітів
У концентрації колігативних властивостей одного і того ж розчину електроліту воно має більше значення, коли ми порівнюємо його із колігативними властивостями неелектролітного розчину. Через велику кількість частинок розчиненої речовини, що виникають в результаті реакції іонізації розчину електроліту, яка була сформульована як коефіцієнт Ван-Гоффа.
Розрахунок колігативних властивостей розчину електроліту завжди помножується на коефіцієнт Ван-Гоффа наступним чином:

Джерело: formula.co.id
Деякі формули колігативних властивостей інших розчинів електролітів:
- Падіння тиску пари
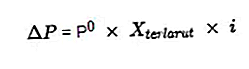
Джерело: formula.co.id
- Збільшення температури кипіння
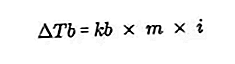
Джерело: formula.co.id
- Падіння точки замерзання
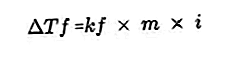
Джерело: formula.co.id
- Осмотичний тиск
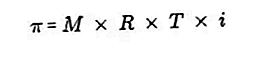
Джерело: formula.co.id
Формули молярності, молярності та мольної частки
Молярність (М)
Молярність - це кількість молей речовини, розчиненої в 1 літрі розчину.

Джерело: formula.co.id
М = молярність
Mr = молярна маса розчиненої речовини (г / моль)
V = об’єм розчину
Молальність (м)
Моляльність - це кількість молей речовини, розчинених в 1 кг розчинника. Хімічна формула така.

Джерело: formula.co.id
m = молярність (моль / кг)
Mr = молярна маса розчиненої речовини (г / моль)
маса = маса розчиненої речовини (г)
P = маса розчинника (г)
Мольна фракція
Мольна частка - це одиниця концентрації, в якій всі компоненти розчину розраховуються на основі молей.

Джерело: formula.co.id
xi = кількість родимок
i, j, xj = мольна частка
Приклади задач хімічної формули
1. Якщо осмотичний тиск 500 мл розчину фруктози, C6H12O6 від 32 ° С дорівнює 2 атм, маса розчиненої фруктози становить?
Рішення:

2. У мольній частці розчину сечовини у воді 0,2. Тиск насиченої пари чистої води з температурою 20 ° C становить 17,5 мм рт. Тоді при тиску насиченої пари розчину при такій температурі дорівнює?
Xсечовина + Xводи = 1
0,2 + Xводи = 1
Xводи = 0,8
Pрішення = Xводи x P води
Pрішення = 0,8 х 17,5 мм рт. Ст
Pрішення = 14 мм рт. Ст
Це деякі хімічні формули, які ви можете навчитися, щоб полегшити вам відповіді на різні види хімічних питань. Якщо ви відчуваєте, що цих формул недостатньо, ви можете спробувати продукт PROBLEM, зважене, повне, онлайн-рішення для практичних питань у Smart Class, таких як тригонометрія, ліміт, логарифм та багато іншого. Починаючи від початкової, молодшої до середньої школи з різними предметами, такими як математика, фізика, хімія та інші. Тут ви можете дізнатись різні типи формул разом із прикладами задач.
Давай, чого ти чекаєш! Давайте спробуємо вправи ПРОБЛЕМИ в Smart Class прямо зараз.